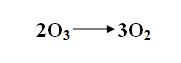Открытый урок по химии в 9 классе коррекционной школы
Строение простых веществ. Аллотропия
Вахрушина Наталья Анатольевна,
учитель химии и биологии ГБОУ Школа №7 (коррекционная школа)
Красносельского района Санкт-Петербурга ,
Цели: сформировать у обучающихся понятие аллотропии на примере химического элемента кислорода.
Задачи:
1. Образовательные: систематизировать знания обучающихся по формированию представлений о кислороде и озоне, как о простых веществах, образованных атомами одного и того же элемента; рассмотреть особенности свойств этих аллотропных видоизменений в связи с их строением.
2. Воспитательные: сформировать у обучающихся понимание роли кислорода и озона для планеты Земля.
3. Развивающие: развивать логическое мышление, способность обобщать, речь, коммуникативные способности, самостоятельность, познавательный интерес, самоконтроль и взаимоконтроль.
Оборудование: компьютер, мультимедийный проектор, периодическая таблица химических элементов Д.И.Менделеева, модели аллотропных видоизменений кислорода.
Ход урока
1. Организационный момент. Приветствие.
- Здравствуйте, ребята! Я рада приветствовать Вас на уроке химии. К нам сегодня пришли гости, давайте поприветствуем их.
2. Проверка готовности учащихся к уроку.
3. Постановка проблемы.
- На слайде №1 написаны формулы, давайте их прочитаем: О2; Н2О; HNO3; H2; Al; O3; C; KOH; Na2SO4; N2; CO2.
- Посмотрите внимательно, на какие группы веществ мы можем их разделить?
- Правильно, на простые и сложные вещества.
- Давайте вспомним, какие вещества называют простыми? Какие сложными?
Слайд №2:
Простыминазывают такие вещества, которые образованы атомами одного вида.
Сложныминазывают такие вещества, которые образованы атомами разного вида.
- А теперь я хочу загадать вам загадку о том веществе, о котором мы с вами будем сегодня говорить. И большая просьба, внимательно меня слушать.
Та история простая...
Джозеф Пристли как-то раз,
Окись ртути нагревая,
Обнаружил
Странный газ!
Газ без цвета,
Без названья,
Ярче в нем горит свеча.
А не вреден для дыханья?..
(Не узнаешь у врача.)
Новый газ из колбы вышел!
Никому он не знаком:
Этим газом дышат мыши
Под стеклянным колпаком.
Человек им тоже дышит!
Джозеф Пристли быстро пишет:
«Воздух делится на части...»
Эта мысль весьма нова...
Здесь у химика от счастья
И от воздуха отчасти
(От его важнейшей части!)
Закружилась голова...
Кошка греется на крыше.
Солнца луч в окошко бьет.
Джозеф Пристли,
С ним две мыши,
Открывают кислород!
Ефим Ефимовский
- Да, правильно, сегодня мы будем рассматривать самый распространенный элемент на планете – кислород.
Открываем тетради, записываем число и тему урока в тетрадь.
- Виталий, познакомь всех нас с темой урока (Слайд №3):Строение простых веществ. Аллотропия.
4. Постановка целей урока.
- Ребята, так о чем мы будем сегодня с вами говорить на уроке?
(Кислород – как простое вещество. Понятие аллотропии.)
5. Объяснение нового материала.
- Что мы о нем уже знаем? Правильно, смотрим куда? В периодическую таблицу Д.И.Менделеева.
(Химический знак - О, название – кислород, читается «о», 2 период, 2 ряд, 6 группа, это неметалл, порядковый номер 8, количество электронов -8, заряд ядра +8).
- А теперь проверим Вас на внимание: кто открыл кислород? (Джозеф Пристли)
(слайд №4)
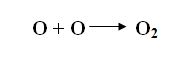
- Какие вещества может образовывать кислород?
- О2, а еще какое? О3 – озон (слайд №5).
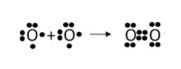
- Почему О2 состоит из 2 атомов? Чтобы ответить на этот вопрос, вспомним электронную и графическую формулы атома кислорода?
- К доске кто пойдет писать? Остальные пишут в тетрадях.
- Ребята, давайте внимательно посмотрим, сколько у кислорода электронов на последнем энергетическом уровне? Сколько не хватает до заполнения? (2 электрона).
- Что бы быть устойчивым соединением в обычном состоянии молекула содержит 2 атома, то есть электроны образуют 2 общие электронные пары.
- Посмотрите на рисунок и сделайте запись в тетрадь.
(слайд №6)
- Какой вид химической связи характерен для молекулы кислорода? (Ковалентная неполярная)
- Что мы еще знаем о кислороде?
Он необходим почти всем живым организмам на Земле. Широко используется в промышленности (слайд №7).
6. Физкультминутка
Объяснение нового материала (продолжение).
Теперь поговорим о втором веществе –обозоне.
- Что связано в нашей жизни с этим понятием?
- Правильно, озон образует вокруг нашей планеты защитный озоновый слой.
- Какая глобальная проблема связана с ним?
(Озоновые дыры, они образуются за счет выбросов металлургических комбинатов, использования спреев, полета ракет и т. д.)
Вот, о каком важном веществе, мы ведем речь, но… для нашего организма тесный контакт с озоном – опасен.
- Чем отличается О3 от О2? Количеством атомов следовательно расположением атомов в молекуле.
(слайд №8)
7. Работа с учебником
- Озон получают в приборе – озонаторе.
Задание:прочитать о строении и принципе работы озонатора (стр. 27).
(слайд №9)
- Озонатор состоит из стеклянной трубки, обвитой снаружи металлической проволокой. Внутри трубки проходит другая металлическая проволока. Стеклянную трубку озонатора наполняют кислородом, а концы проволоки присоединяют к полюсам индукционной катушки для получения тока высокого напряжения. Между проволоками и, следовательно, через кислород пропускают электрический разряд. В результате кислород превращается в озон (слайд №10):
- Расскажите принцип работы озонатора.
- Скажите, какие явления происходят в природе, напоминающие деятельность озонатора?
(Гроза. И еще окисление смолы хвойных деревьев).
- Вспомним, какой воздух после дождя? И в хвойном лесу?
(Приятный свежий воздух).
- Рассмотрим подробнее это второе видоизменение кислорода.
Озон– это газ с характерным запахом, в 1,5 раза тяжелее кислорода и лучше растворяется в воде.
Озонхимически значительно активнее кислорода, так как его молекулы легко распадаются (слайд №11):
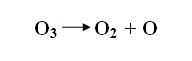
- Образующийся атомарный кислород более энергично реагирует с веществами, чем молекулярный. Он соединяется попарно в молекулы (слайд №12):
- Поэтому превращение озона в кислород выражают следующим уравнением (слайд №13):
- Таким образом, что мы узнали об озоне? о кислороде?
- Действительно, мы с вами познакомились с двумя простыми веществами – это кислород и озон. Они образованы одним химическим элементом. Такие вещества называются аллотропными видоизменениями. А явление, когда один и тот же химический элемент образует несколько простых веществ, называют аллотропией.
Запишите определения в тетрадь (слайд №14):
Аллотропия– это явление, когда один и тот же химический элемент образует несколько простых веществ.
Аллотропные видоизменения– это простые вещества, образованные одним и тем же химическим элементом.
8. Итоги урока
- Давайте подведем итоги, что мы сегодня рассмотрели на уроке, с чем познакомились?
9. Домашнее задание:
1)§8;
2) Найти и записать аллотропные видоизменения других химических элементов.
10. Оценивание учащихся, с комментариями.
Используемая литература:
1. Рудзитис Г.Е., Фельдман Ф.Г. «Химия 9 класс»- М. «Просвещение», 2012 г.
2. Химия. 9 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия. 9» / О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. - М.: Дрофа, 2007 г.
3. Репетитор по химии под ред. А.С. Егорова – Ростов н/Д «Феникс», 2005 г.
4. Габриелян О. С., Остроумов И. Г. Изучаем химию в 9 кл.: Дидактические материалы. — М.: Блик плюс, 2004 г.